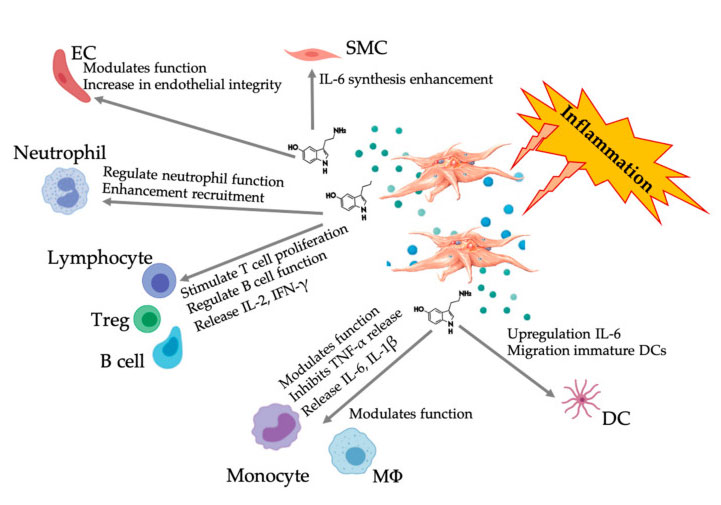
Úloha krevních destiček v koncentrátu aspirace kostní dřeně
PRP a koncentrát aspirace kostní dřeně (BMAC) se používají pro řadu klinických ošetření v kancelářském prostředí a chirurgii kvůli jejich regeneračním přínosům při MSK a onemocněních páteře, léčbě chronické bolesti a indikacích měkkých tkání.PRP nejen reguluje buněčnou migraci a buněčnou proliferaci, ale také přispívá k angiogenezi a remodelaci ECM za účelem vytvoření příznivého mikroprostředí a podpory opravy a regenerace tkání.
Proces opravy BMAC
BMAC jsou heterogenní buněčné kompozice obsahující BMMSC, což z nich činí endogenní buněčný zdroj pro regenerativní medicínu opravnou terapii.Hrají roli při snižování buněčné apoptózy, fibrózy a zánětu;A aktivovat kaskádovou reakci vedoucí k buněčné proliferaci.Kromě toho mají BMMSC potenciál diferencovat se do různých buněčných linií, včetně osteoblastů, adipocytů, myoblastů, epiteliálních buněk a neuronů.Podporují také angiogenezi prostřednictvím parakrinních a autokrinních drah.Je také důležité, že BMMSC přispívá k imunitní regulaci nezávislé na imunitních specifických buňkách, které se účastní zánětlivého stádia hojení ran.Kromě toho BMMSC podporují nábor buněk do nových míst angiogeneze pro urychlení místní rekonstrukce krevního toku.Jin a kol.Bylo prokázáno, že při absenci dostatečných skafoldů byla poškozena míra přežití BMMSC a jeho opravná a diferenciační schopnost podporovat hojení.Přestože se odběr tkáně, příprava vzorku a mechanismus účinku PRP a BMAC liší, studie ukazují, že se mohou vzájemně doplňovat.Ve skutečnosti může mít kombinace PRP a BMAC do biologického produktu další výhody.
Kombinace PRP a BMAC
Podle některých málo známých výzkumů je základní princip kombinace PRP a BMAC založen na několika premisách.Za prvé, PRP může poskytnout vhodné mikroprostředí, ve kterém BMSC může zvýšit buněčnou proliferaci a diferenciaci a zvýšit angiogenezi.Za druhé, PRP byl použit jako lešení pro tyto buňky spolu s BMAC.Naopak, kombinace PRP a BMAC se může stát mocným biologickým nástrojem k přilákání populace BMMSC.Sloučenina PRP-BMAC se používá k léčbě tendinóz, ran, poranění míchy, degenerativních meziobratlových plotének a osteochondrálních defektů s velkým regeneračním potenciálem.Bohužel, ačkoli heterogenní složky buněk kostní dřeně zahrnují krevní destičky, jen málo zpráv uvádí koncentraci krevních destiček v extrahované kostní dřeni a po léčbě BMAC, ale mohou být extrahovány vhodnými aspiračními metodami.Je zapotřebí dalšího výzkumu, abychom pochopili, zda je nutné použít další koncentráty krevních destiček v kombinaci s BMAC.V současné době neexistují žádné údaje o optimálním poměru krevních destiček k buňkám MSC (nebo jiných buněk kostní dřeně), což má pozitivní dopad na nutriční mechanismus MSC při reparaci tkání.V ideálním případě lze zařízení a technologii pro odběr kostní dřeně optimalizovat tak, aby extrahovalo dostatek krevních destiček kostní dřeně.
PRP růstový faktor a nutriční efekt BMAC
PRP destičkový růstový faktor je klíčovým proteinem zapojeným do procesu opravy BMAC.Rozmanitost PGF a dalších cytokinů zapojených do nutričního procesu BMAC může zahájit opravu tkáně snížením buněčné apoptózy, anabolismu a protizánětlivých účinků a aktivací buněčné proliferace, diferenciace a angiogeneze prostřednictvím parakrinních a autokrinních cest.
Růstový faktor pocházející z krevních destiček a složky hustých granulí se zjevně podílejí na nutričním procesu BMAC a podporují opravu a regeneraci tkání vyvolanou MSC.Zkratky: MSC: mezenchymální kmenové buňky, HSC: hematopoetické kmenové buňky.
Je zřejmé, že při léčbě OA hraje PDGF specifickou roli v regeneraci chrupavky a udržování homeostázy prostřednictvím proliferace MSC a inhibice IL-1-indukované apoptózy chondrocytů a zánětu.Kromě toho jsou tři podtypy TGF-P aktivní při stimulaci tvorby chrupavky a inhibici zánětu a vykazují schopnost podporovat hojení tkáně související s MSC prostřednictvím intermolekulární interakce.Nutriční účinek MSC souvisí s aktivitou PGF a sekrecí reparačních cytokinů.V ideálním případě by všechny tyto cytokiny měly být přítomny v léčebné láhvi BMAC a transportovány do místa poranění tkáně, aby se podpořilo nejlepší terapeutické hojení tkáně související s MSC.
Ve společné studii OA Mui ñ os-L ó pez et al.Ukazuje, že MSC pocházející ze synoviální tkáně změnily funkci, což má za následek ztrátu schopnosti obnovy.Je zajímavé, že přímá injekce PRP do subchondrální kosti osteoartrózy vedla ke snížení MSC v synoviální tekutině, což ukazuje na klinické zlepšení.Terapeutický účinek je zprostředkován snížením zánětlivého procesu v synoviální tekutině pacientů s OA.
Je málo dostupných informací o přítomnosti nebo koncentraci PGF v BMAC nebo o ideálním poměru požadovaném pro podporu nutriční funkce BMMSC.Někteří lékaři kombinují vysokou koncentraci PRP s BMAC, aby získali více biologicky aktivních štěpů, od kterých se očekává, že optimalizují léčebné výsledky regenerativní medicíny.Existuje však málo dostupných údajů o bezpečnosti a účinnosti, což naznačuje, že kombinace vysoké koncentrace PRP s BMAC je účinnější možností léčby.Proto se domníváme, že v této fázi nemusí být vhodné manipulovat s BMMSC jejich aktivací vysokou koncentrací krevních destiček.
Interakce krevních destiček s protidestičkovými léky a NSAID
PRP obsahuje široké spektrum sekrečních složek a skládá se z mnoha biologických médií.Těmto mediátorům je přisuzován terapeutický účinek PRP.Ačkoli jsou terapeutické mediátory v krevních destičkách dobře známy, optimální formulace a kinetika těchto anabolických a katabolických léčiv nejsou zcela jasné.Jedním z hlavních omezení dosažení terapeutických formulací je překonat variabilitu těchto biologických mediátorů, aby bylo možné zaměřit se na dobře regulované následné účinky, které jsou vždy opakovatelné a klinicky prospěšné.Z tohoto důvodu mohou léky (jako jsou nesteroidní protizánětlivé léky (NSAID)) ovlivnit uvolňování sekrečních skupin krevních destiček.V nedávné otevřené studii s fixní sekvencí snížil denní příjem 81 mg aspirinu (ASA) expresi klíčových mediátorů, jako je TGF-β 1, PDGF a VEGF.
Tyto účinky jsou připisovány ireverzibilní inhibici cyklooxygenázy-1 (COX-1) a nastavitelné inhibici cyklooxygenázy-2 (COX-2), což jsou dva enzymy potřebné pro následnou degranulaci krevních destiček.Nedávný systematický přehled zjistil, že protidestičkové léky mohou snížit křivku uvolňování růstového faktoru v závislosti na COX-1 a COX-2 a 8 z 15 studií zjistilo, že růstové faktory se snížily.
K úlevě od bolesti a snížení zánětu způsobeného onemocněním MSK se obvykle používají léky (např. NSAID).Mechanismus NSAID spočívá v inhibici aktivace krevních destiček ireverzibilní vazbou s enzymem COX a regulací dráhy kyseliny arachidonové.Funkce krevních destiček se tedy bude měnit v průběhu celého životního cyklu krevních destiček, čímž se zabrání přenosu signálu PGF.NSAID inhibují produkci cytokinů (např. PDGF, FGF, VEGF a IL-1 β, IL-6 a IL-8), zatímco zvyšují TNF-α. Existuje však málo údajů o molekulárním dopadu NSAID na PRP.Nepanuje shoda ohledně nejvhodnější doby pro přípravu a podání PRP u pacientů užívajících NSAID.Mannava a kolegové kvantifikovali anabolické a katabolické biologické faktory v PRP bohaté na leukocyty u zdravých dobrovolníků užívajících naproxen.Zjistili, že po používání naproxenu po dobu jednoho týdne se hladiny PDGF-AA a PDGF-AB (účinný mitogen pro podporu angiogeneze) významně snížily.Po jednom týdnu se hladina růstového faktoru vrátila blízko základní úrovně.Po týdenním používání naproxenu se hladina LR-PRP prozánětlivého a katabolického faktoru IL-6 také snížila a po týdenním období clearance se vrátila na výchozí hladinu.V současné době neexistuje žádná klinická studie, která by prokázala, že pacienti s naproxenem po léčbě PRP mají negativní výsledky;Doporučuje se však zvážit jednotýdenní promývací období, aby se obnovily hodnoty PDGF-AA, PDGF-BB a IL-6 na výchozí úroveň, aby se zlepšila jejich biologická aktivita.K úplnému pochopení účinků antiagregačních látek a NSAID na skupinu sekrece PRP a její následné cíle je zapotřebí více výzkumu.
Kombinujte aplikaci plazmy bohaté na krevní destičky s rehabilitací
Ačkoli základní vědecký výzkum ukazuje, že fyzikální terapie a mechanická zátěž mají jasnou roli v obnově struktury šlachy po injekci PRP, neexistuje konsenzus o nejlepším rehabilitačním plánu pro onemocnění MSK po léčbě PRP.
Léčba PRP zahrnuje injekci koncentrovaných krevních destiček do místního tkáňového prostředí pro regulaci bolesti a podporu opravy tkáně.Nejsilnější klinické důkazy existují u OA kolena.Použití PRP v léčbě symptomatické tendinózy je však kontroverzní a uváděné výsledky se liší.Studie na zvířatech obvykle ukazují histologické zlepšení tendinózy po infiltraci PRP.Tyto studie ukazují, že mechanické zatížení může regenerovat šlachy a zatížení a injekce PRP spolupracují na podpoře hojení šlach.Rozdíly v přípravcích PRP, biologických přípravcích, přípravcích, injekčních schématech a podtypech poranění šlach mohou vést k rozdílům v klinických výsledcích.Kromě toho, ačkoli vědecké důkazy podporují výhody rehabilitačních plánů, jen málo publikovaných klinických studií se pokouší řídit a integrovat konzistentní rehabilitační plány po PRP.
Nedávno Onishi et al.Byla přezkoumána role mechanické zátěže a biologického účinku PRP u onemocnění Achillovy šlachy.Hodnotili klinické studie fáze I a fáze II onemocnění Achillovy šlachy léčené PRP se zaměřením na rehabilitační plán po injekci PRP.Zdá se, že kontrolované rehabilitační programy zlepšují dodržování cvičení a zlepšují výsledky a schopnost monitorovat dávku cvičení.Několik dobře navržených studií PRP Achillovy šlachy kombinovalo léčbu po PRP s plánem rehabilitace mechanické zátěže jako nedílnou součást strategie regenerace.
Výhled do budoucna a závěry
Technický pokrok zařízení a metod přípravy PRP ukazuje slibné výsledky pacientů, ačkoli definice různých biologických látek PRP a příslušné biologické vlastnosti konečného produktu jsou stále neprůkazné.Navíc nebyl stanoven plný potenciál indikací a aplikací PRP.Donedávna byl PRP komerčně prodáván jako autologní krevní derivát, který může lékařům poskytnout možnost používat technologii autologního trombocytárního růstového faktoru u konkrétní indikované patologie a onemocnění.Nejprve je jediným často uváděným kritériem úspěšné aplikace PRP připravený vzorek, jehož koncentrace trombocytů je vyšší než hodnota plné krve.Dnes už naštěstí praktici chápou fungování PRP komplexněji.
V tomto přehledu uznáváme, že stále existuje nedostatek standardizace a klasifikace v technologii přípravy;Proto v současnosti neexistuje konsenzus o biologických látkách PRP, i když více literatury dosáhlo shody o účinné koncentraci dávky krevních destiček potřebné k podpoře (nové) angiogeneze.Zde jsme stručně představili aktivitu PGF, ale šířeji jsme odráželi specifický mechanismus krevních destiček a efektorový efekt bílých krvinek a MSC, stejně jako následnou interakci buňka-buňka.Zejména přítomnost bílých krvinek v přípravcích PRP poskytuje hlubší pochopení škodlivých nebo prospěšných účinků.Byla diskutována jasná úloha krevních destiček a jejich interakce s vrozeným a adaptivním imunitním systémem.Kromě toho je zapotřebí dostatečných a dobře zdokumentovaných klinických studií ke stanovení plného potenciálu a terapeutického účinku PRP v různých indikacích.
(Obsah tohoto článku je přetištěn a neposkytujeme žádnou výslovnou ani předpokládanou záruku za přesnost, spolehlivost nebo úplnost obsahu obsaženého v tomto článku a neneseme odpovědnost za názory na tento článek, pochopte prosím.)
Čas odeslání: březen-01-2023