Moderní PRP: „klinické PRP“
Za posledních 10 let prošlo léčebné schéma PRP velkými změnami.Prostřednictvím experimentálního a klinického výzkumu nyní lépe rozumíme fyziologii krevních destiček a dalších buněk.Kromě toho několik vysoce kvalitních systematických hodnocení, metaanalýz a randomizovaných kontrolovaných studií prokázalo účinnost biotechnologie PRP v mnoha lékařských oborech, včetně dermatologie, kardiochirurgie, plastické chirurgie, ortopedické chirurgie, léčby bolesti, onemocnění páteře a sportovní medicíny. .
Současnou charakteristikou PRP je jeho absolutní koncentrace krevních destiček, která se z počáteční definice PRP (včetně koncentrace krevních destiček vyšší než výchozí hodnota) mění na více než 1 × 106/µl nebo přibližně 5násobek minimální koncentrace krevních destiček v krevních destičkách od základní linie.V rozsáhlém přehledu Fadadu et al.Bylo hodnoceno 33 PRP systémů a protokolů.Počet krevních destiček v konečném přípravku PRP vyrobeném některými z těchto systémů je nižší než v plné krvi.Uvedli, že faktor krevních destiček PRP se zvýšil až na 0,52 se soupravou pro jedno odstřeďování (Selphyl®).Naproti tomu EmCyte Genesis PurePRPII® s dvojitou rotací Koncentrace krevních destiček produkovaná zařízením je nejvyšší (1,6 × 10 6 /µL).
Je zřejmé, že in vitro a zvířecí metody nejsou ideálním výzkumným prostředím pro úspěšnou transformaci do klinické praxe.Podobně srovnávací studie zařízení nepodporuje toto rozhodnutí, protože ukazuje, že koncentrace krevních destiček mezi zařízeními PRP je velmi odlišná.Naštěstí pomocí technologie a analýzy založené na proteomice můžeme lépe porozumět buněčným funkcím v PRP, které ovlivňují výsledky léčby.Před dosažením konsensu o standardizovaných přípravcích a formulacích PRP by se PRP měla řídit klinickými formulacemi PRP, aby se podpořily podstatné mechanismy opravy tkání a progresivní klinické výsledky.
Klinický vzorec PRP
V současnosti je účinná klinická PRP (C-PRP) charakterizována jako komplexní složení autologních mnohobuněčných složek v maloobjemové plazmě získané z části periferní krve po centrifugaci.Po odstředění lze PRP a jeho nedestičkové buněčné složky získat z koncentračního zařízení podle různých hustot buněk (z nichž hustota destiček je nejnižší).
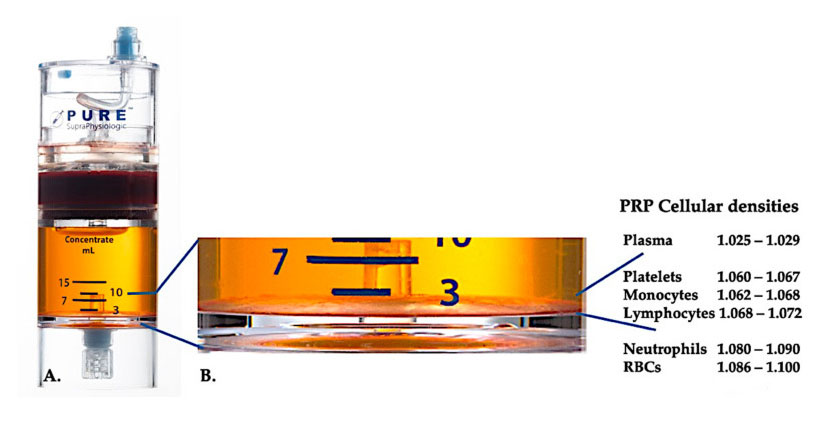
Použití Zařízení pro separaci hustoty buněk PurePRP-SP® (EmCyte Corporation, Fort Myers, FL, USA) bylo použito pro plnou krev po dvou centrifugačních postupech.Po prvním procesu odstřeďování byla složka plné krve rozdělena na dvě základní vrstvy, suspenzi trombocytů (chudé) plazmy a vrstvu červených krvinek.V A byl dokončen druhý krok odstřeďování.Aktuální objem PRP lze extrahovat pro aplikaci u pacienta.Zvětšení v B ukazuje, že na dně zařízení je organizovaná vícesložková sedimentace erytrocytů hnědá vrstva (reprezentovaná modrou čarou), která obsahuje vysoké koncentrace krevních destiček, monocytů a lymfocytů, na základě hustotního gradientu.V tomto příkladu, podle protokolu přípravy C-PRP se špatnými neutrofily, bude extrahováno minimální procento neutrofilů (<0,3 %) a erytrocytů (<0,1 %).
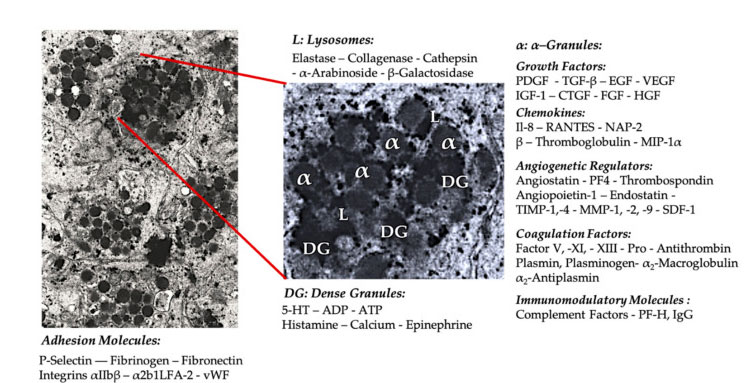
Krevní destičkové granule
V časné klinické aplikaci PRP jsou α-granule nejčastěji citovanou vnitřní strukturou destiček, protože obsahují koagulační faktory, velké množství PDGF a angiogenních regulátorů, ale mají malou trombogenní funkci.Mezi další faktory patří méně známé chemokinové a cytokinové složky, jako je destičkový faktor 4 (PF4), předdestičkový bazický protein, P-selektin (aktivátor integrinu) a chemokin RANTES (regulovaný aktivací, exprimující normální T buňky a pravděpodobně vylučování).Celková funkce těchto specifických složek destičkových granulí je nábor a aktivace dalších imunitních buněk nebo indukce zánětu endoteliálních buněk.
Husté granulární složky jako ADP, serotonin, polyfosfát, histamin a adrenalin se implicitněji používají jako regulátory aktivace krevních destiček a trombózy.A co je nejdůležitější, mnoho z těchto prvků má funkci modifikace imunitních buněk.Destičkový ADP je rozpoznán receptorem P2Y12ADP na dendritických buňkách (DC), čímž se zvyšuje antigenní endocytóza.DC (antigen presenting cell) je velmi důležitá pro iniciaci imunitní reakce T buněk a řízení ochranné imunitní reakce, která spojuje vrozený imunitní systém a adaptivní imunitní systém.Navíc destičkový adenosintrifosfát (ATP) vysílá signály přes T buněčný receptor P2X7, což vede ke zvýšené diferenciaci CD4 T pomocných buněk na prozánětlivé T pomocné 17 (Th17) buňky.Jiné složky granulí s hustotou krevních destiček (jako je glutamát a serotonin) indukují migraci T buněk a zvyšují diferenciaci monocytů na DC.V PRP jsou tyto imunomodulátory odvozené z hustých částic vysoce obohacené a mají podstatné imunitní funkce.
Počet přímých a nepřímých potenciálních interakcí mezi krevními destičkami a jinými (receptorovými) buňkami je rozsáhlý.Proto aplikace PRP v lokálním patologickém tkáňovém prostředí může vyvolat různé zánětlivé účinky.
Koncentrace krevních destiček
C-PRP by měl obsahovat klinické dávky koncentrovaných krevních destiček, aby vyvolal příznivé terapeutické účinky.Krevní destičky v C-PRP by měly stimulovat buněčnou proliferaci, syntézu mezenchymálních a neurotrofních faktorů, podporovat migraci chemotaktických buněk a stimulovat imunoregulační aktivitu, jak je znázorněno na obrázku.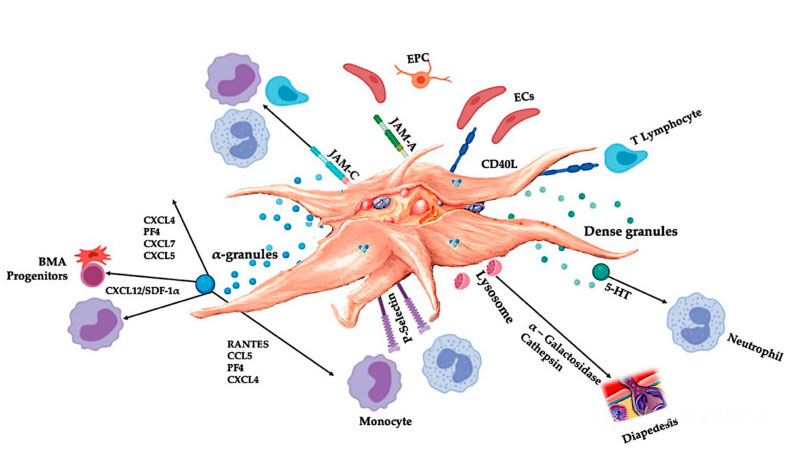
Aktivované krevní destičky, uvolňování PGF a adhezivní molekuly zprostředkovávají různé buněčné interakce: chemotaxi, buněčnou adhezi, migraci a buněčnou diferenciaci a regulují imunitní regulační aktivity.Tyto interakce destička-buňka přispívají k angiogenezi a zánětlivé aktivitě a nakonec stimulují proces opravy tkáně.Zkratky: BMA: aspirát kostní dřeně, EPC: endoteliální progenitorové buňky, EC: endoteliální buňky, 5-HT: 5-hydroxytryptamin, RANTES: aktivovaná regulace normální exprese T buněk a domnělé sekrece, JAM: typ spojovací adhezní molekuly, CD40L: cluster 40 ligand, SDF-1 α: Faktor 1 odvozený ze stromálních buněk, CXCL: chemokinový (CXC motiv) ligand, PF4: destičkový faktor 4. Upraveno podle Everts et al.
Marx byl první osobou, která dokázala, že se zlepšilo hojení kostí a měkkých tkání a minimální počet krevních destiček byl 1 × 10 6 /µL. 1,3 × Při 106 krevních destičkách/µl tato studie prokázala větší fúzi.Kromě toho Giusti et al.Odhaleno 1,5 × Mechanismus opravy tkáně v dávce 109 vyžaduje krevní destičky/ml k indukci funkční angiogeneze prostřednictvím aktivity endoteliálních buněk.V poslední studii vyšší koncentrace snižovaly potenciál angiogeneze krevních destiček ve folikulech a kolem nich.Dřívější údaje navíc ukázaly, že dávka PRP také ovlivní výsledky léčby.Proto, aby se významně indukovala angiogenezní reakce a stimulovala buněčná proliferace a migrace buněk, C-PRP by měl obsahovat alespoň 7,5 v 5ml léčebné lahvičce PRP × 109 může dodávat krevní destičky.
Kromě závislosti na dávce se zdá, že účinek PRP na buněčnou aktivitu je vysoce závislý na čase.Sophie a kol.Tyto výsledky naznačují, že krátkodobá expozice lyzátům lidských krevních destiček může stimulovat proliferaci kostních buněk a chemotaxi.Naopak dlouhodobá expozice PRP povede k nižším hladinám alkalické fosfatázy a tvorbě minerálů.
červená krvinka
Červené krvinky jsou zodpovědné za transport kyslíku do tkání a přenos oxidu uhličitého z tkání do plic.Nemají žádné jádro a jsou složeny z molekul hemu, které se vážou na proteiny.Složky železa a hemu v červených krvinkách podporují kombinaci kyslíku a oxidu uhličitého.Obecně je životní cyklus červených krvinek asi 120 dní.Z oběhu jsou odstraňovány makrofágy prostřednictvím procesu zvaného stárnutí červených krvinek.Červené krvinky ve vzorcích PRP mohou být poškozeny při smykových podmínkách (například při operaci krvácení z plné krve, imunitně zprostředkovaném procesu, oxidačním stresu nebo neadekvátním schématu koncentrace PRP).Proto se buněčná membrána červených krvinek rozkládá a uvolňuje toxický hemoglobin (Hb), měřeno volným hemoglobinem v plazmě (PFH), hemem a železem.].PFH a jeho degradační produkty (hem a železo) společně vedou ke škodlivým a cytotoxickým účinkům na tkáně, což vede k oxidačnímu stresu, ztrátě oxidu dusnatého, aktivaci zánětlivých cest a imunosupresi.Tyto účinky nakonec povedou k dysfunkci mikrocirkulace, lokální vazokonstrikci a vaskulárnímu poranění, stejně jako vážnému poškození tkáně.
Nejdůležitější je, že když jsou červené krvinky obsahující C-PRP doručeny do tkáně, způsobí lokální reakci zvanou eryptóza, která spustí uvolňování účinného inhibitoru migrace cytokinů a makrofágů.Tento cytokin inhibuje migraci monocytů a makrofágů.Vydává silné prozánětlivé signály do okolních tkání, inhibuje migraci kmenových buněk a proliferaci fibroblastů a vede k významné lokální dysfunkci buněk.Proto je důležité omezit kontaminaci RBC v přípravcích PRP.Navíc úloha červených krvinek při regeneraci tkání nebyla nikdy stanovena.Adekvátní centrifugace a proces přípravy C-PRP obvykle sníží nebo dokonce odstraní přítomnost červených krvinek, čímž se zabrání nepříznivým následkům hemolýzy a polycytémie.
Leukocyty v C-PRP
Přítomnost bílých krvinek v přípravcích PRP závisí na léčebném zařízení a schématu přípravy.V zařízeních pro PRP na bázi plazmy jsou bílé krvinky zcela eliminovány;Bílé krvinky se však významně koncentrovaly v PRP preparátu sedimentační hnědé vrstvy erytrocytů.Bílé krvinky díky svým imunitním a obranným mechanismům hostitele výrazně ovlivňují vnitřní biologii akutních a chronických tkáňových stavů.Tyto vlastnosti budou dále diskutovány níže.Proto přítomnost specifických leukocytů v C-PRP může způsobit významné buněčné a tkáňové účinky.Přesněji řečeno, různé systémy hnědožluté vrstvy sedimentace erytrocytů PRP používají různá schémata přípravy, a tak produkují různý podíl neutrofilů, lymfocytů a monocytů v PRP.Eozinofily a bazofily nelze v PRP preparátech měřit, protože jejich buněčné membrány jsou příliš křehké, aby vydržely odstředivé zpracovatelské síly.
Neutrofily
Neutrofily jsou nezbytné leukocyty v mnoha léčebných cestách.Tyto dráhy se spojují s antimikrobiálními proteiny přítomnými v krevních destičkách a vytvářejí hustou bariéru proti invazivním patogenům.Existence neutrofilů se určuje podle cíle léčby C-PRP.Zvýšené úrovně zánětu tkání mohou být vyžadovány při péči o chronické rány PRP bioterapií nebo při aplikacích zaměřených na růst nebo hojení kostí.Důležité je, že v několika modelech byly nalezeny další funkce neutrofilů, což zdůrazňuje jejich roli v angiogenezi a opravě tkáně.Neutrofily však mohou mít také škodlivé účinky, takže pro některé aplikace nejsou vhodné.Zhou a Wang prokázali, že použití PRP bohatého na neutrofily může vést ke zvýšení poměru kolagenu typu III ke kolagenu typu I, a tím k exacerbaci fibrózy a snížení pevnosti šlach.Další škodlivé vlastnosti zprostředkované neutrofily jsou uvolňování zánětlivých cytokinů a matrixových metaloproteináz (MMP), které mohou podporovat zánět a katabolismus při aplikaci do tkání.
Leukomonocyt
U C-PRP jsou mononukleární T a B lymfocyty koncentrovanější než jakékoli jiné bílé krvinky.Úzce souvisí s buněčně zprostředkovanou cytotoxickou adaptivní imunitou.Lymfocyty mohou vyvolat buněčné reakce v boji s infekcí a adaptovat se na útočníky.Kromě toho cytokiny odvozené od T-lymfocytů (interferon-γ [IFN-γ] a interleukin-4 (IL-4) zvyšují polarizaci makrofágů. Verassar et al. Je prokázáno, že konvenční T lymfocyty mohou nepřímo podporovat hojení tkání v myší model regulací diferenciace monocytů a makrofágů.
Monocyt – multipotentní opravná buňka
Podle použitého zařízení pro přípravu PRP mohou monocyty vyčnívat nebo nemusí existovat v láhvi pro ošetření PRP.Bohužel o jejich výkonnosti a schopnosti regenerace se v literatuře mluví jen zřídka.Proto je monocytům v metodě přípravy nebo konečné formuli věnována malá pozornost.Skupina monocytů je heterogenní, pochází z progenitorových buněk v kostní dřeni a je transportována do periferních tkání cestou hematopoetických kmenových buněk podle stimulace mikroprostředí.Během homeostázy a zánětu opouštějí cirkulující monocyty krevní oběh a jsou rekrutovány do poraněných nebo degradovaných tkání.Mohou působit jako makrofágy (M Φ) efektorové buňky nebo progenitorové buňky.Monocyty, makrofágy a dendritické buňky představují mononukleární fagocytární systém (MPS). Typickým znakem MPS je plasticita vzoru genové exprese a funkční překrývání těchto typů buněk.V degenerovaných tkáních rezidentní makrofágy, lokálně působící růstové faktory, prozánětlivé cytokiny, apoptotické nebo nekrotické buňky a mikrobiální produkty iniciují monocyty k diferenciaci do skupin buněk MPS.Předpokládejme, že když je C-PRP obsahující monocyty s vysokým výtěžkem injikován do místního mikroprostředí onemocnění, monocyty se pravděpodobně diferencují na M Φ, aby způsobily velké buněčné změny.
Od monocytu k M Φ V procesu transformace, specifický M Φ fenotyp.V posledních deseti letech byl vyvinut model, který integruje M Φ Komplexní mechanismus aktivace je popsán jako polarizace dvou opačných stavů: M Φ fenotyp 1 (M Φ 1, klasická aktivace) a M Φ fenotyp 2 (M Φ 2, alternativní aktivace).M Φ 1 je charakterizována sekrecí zánětlivých cytokinů (IFN-γ) a oxidem dusnatým k produkci účinného mechanismu zabíjení patogenů.M Φ Fenotyp také produkuje vaskulární endoteliální růstový faktor (VEGF) a fibroblastový růstový faktor (FGF).M Φ Fenotyp je složen z protizánětlivých buněk s vysokou fagocytózou.M Φ 2 Produkují složky extracelulární matrix, angiogenezi a chemokiny a interleukin 10 (IL-10).Kromě ochrany proti patogenům může M Φ také snížit zánět a podporovat opravu tkání.Je pozoruhodné, že M Φ 2 bylo rozděleno na M in vitro Φ 2a、M Φ 2b a M Φ 2. Závisí to na stimulu.In vivo translace těchto podtypů je obtížná, protože tkáň může obsahovat smíšené M Φ skupiny.Zajímavé je, že na základě lokálních environmentálních signálů a hladin IL-4 může být prozánětlivý M Φ 1 konvertován tak, aby podporoval opravu M Φ 2. Z těchto údajů je rozumné předpokládat, že existují vysoké koncentrace monocytů a M Φ C-PRP přípravků mohou přispívat k lepší opravě tkáně, protože mají protizánětlivou opravu tkáně a schopnost přenosu buněčného signálu.
Zmatená definice frakce bílých krvinek v PRP
Přítomnost bílých krvinek v lahvích pro léčbu PRP závisí na zařízení pro přípravu PRP a může mít významné rozdíly.Existuje mnoho sporů o existenci leukocytů a jejich příspěvku k různým sub-PRP produktům (jako jsou PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF a L-PRF) V nedávném přehledu šest randomizovaných kontrolované studie (úroveň důkazu 1) a tři prospektivní srovnávací studie (úroveň důkazu 2) zahrnovaly 1055 pacientů, což naznačuje, že LR-PRP a LP-PRP měly podobnou bezpečnost.Autor dospěl k závěru, že nežádoucí reakce PRP nemusí přímo souviset s koncentrací bílých krvinek.V jiné studii LR-PRP nezměnil zánětlivý interleukin (IL-1) u OA kolena β、 IL-6, IL-8 a IL-17).Tyto výsledky podporují názor, že úloha leukocytů v biologické aktivitě PRP in vivo může pocházet z přeslechů mezi krevními destičkami a leukocyty.Tato interakce může podporovat biosyntézu dalších faktorů (jako je lipoxygen), které mohou kompenzovat nebo podporovat regresi zánětu.Po počátečním uvolnění zánětlivých molekul (kyseliny arachidonové, leukotrienu a prostaglandinu) se z aktivovaných krevních destiček uvolňuje lipoxygen A4, aby se zabránilo aktivaci neutrofilů.Právě v tomto prostředí dochází k přechodu fenotypu M Φ z M Φ 1 na M Φ 2。 Navíc přibývá důkazů, že cirkulující mononukleární buňky se mohou díky své pluripotenci diferencovat na různé nefagocytární typy buněk.
Typ PRP ovlivní kulturu MSC.Ve srovnání se vzorky čistého PRP nebo PPP může LR-PRP indukovat významně vyšší proliferaci MSC derivovaných z kostní dřeně (BMMSC) s rychlejším uvolňováním a lepší biologickou aktivitou PGF.Všechny tyto vlastnosti napomáhají přidání monocytů do léčebné lahvičky PRP a rozpoznání jejich imunomodulační schopnosti a diferenciačního potenciálu.
Vrozená a adaptivní imunitní regulace PRP
Nejznámější fyziologickou funkcí krevních destiček je kontrola krvácení.Hromadí se v místě poškození tkáně a poškozených cév.Tyto děje jsou způsobeny expresí integrinů a selektinů, které stimulují adhezi a agregaci krevních destiček.Poškozený endotel tento proces dále zhoršuje a obnažený kolagen a další proteiny subendoteliální matrice podporují hlubokou aktivaci krevních destiček.V těchto případech byla prokázána důležitá role interakce mezi von Willebrandovým faktorem (vWF) a glykoproteinem (GP), zejména GP-Ib.Po aktivaci destiček destičkové α-、 Dense, lysozomy a T-granule regulují exocytózu a uvolňují svůj obsah do extracelulárního prostředí.
Molekula adheze krevních destiček
Abychom lépe porozuměli roli PRP v zánětlivých tkáních a krevních destičkách v imunitní odpovědi, měli bychom porozumět tomu, jak mohou různé povrchové receptory krevních destiček (integriny) a spojovací adhezní molekuly (JAM) a buněčné interakce iniciovat kritické procesy ve vrozené a adaptivní imunitě.
Integriny jsou buněčné povrchové adhezní molekuly nacházející se v různých typech buněk a exprimované ve velkém množství na krevních destičkách.Integriny zahrnují a5bl, a6bl, a2b1 LFA-2, (GPIa/IIa) a aIIbb3 (GPIIb/IIIa).Obvykle existují ve statickém a nízkoafinitním stavu.Po aktivaci přecházejí do stavu vysoké vazebné afinity k ligandu.Integriny mají na krevních destičkách různé funkce a podílejí se na interakci krevních destiček s několika typy bílých krvinek, endoteliálních buněk a extracelulární matrix.Kromě toho je komplex GP-Ib-V-IX exprimován na membráně krevních destiček a je hlavním receptorem pro vazbu s von vWF.Tato interakce zprostředkovává počáteční kontakt mezi krevními destičkami a exponovanými subendoteliálními strukturami.Destičkový integrin a GP komplex souvisí s různými zánětlivými procesy a hrají důležitou roli při tvorbě komplexu destička-leukocyty.Konkrétně je integrin aIIbb3 nezbytný pro vytvoření stabilního komplexu kombinací fibrinogenu s receptorem pro antigen makrofága 1 (Mac-1) na neutrofilech.
Krevní destičky, neutrofily a vaskulární endoteliální buňky exprimují specifické buněčné adhezní molekuly, nazývané selektin.Za zánětlivých stavů krevní destičky exprimují P-selektin a neutrofilní L-selektin.Po aktivaci krevních destiček se P-selektin může vázat na ligand PSGL-1, který existuje na neutrofilech a monocytech.Navíc vazba PSGL-1 iniciuje intracelulární signální kaskádovou reakci, která aktivuje neutrofily prostřednictvím neutrofilního integrinu Mac-1 a antigenu 1 souvisejícího s funkcí lymfocytů (LFA-1).Aktivovaný Mac-1 se váže na GPIb nebo GPIIb/IIIa na krevních destičkách prostřednictvím fibrinogenu, čímž stabilizuje interakci mezi neutrofily a krevními destičkami.Kromě toho se aktivovaný LFA-1 může kombinovat s destičkovou intercelulární adhezní molekulou 2 pro další stabilizaci komplexu neutrofil-destičky pro podporu dlouhodobé adheze s buňkami.
Krevní destičky a leukocyty hrají klíčovou roli ve vrozených a adaptivních imunitních odpovědích
Tělo dokáže rozpoznat cizí tělesa a poraněné tkáně při akutních nebo chronických onemocněních a zahájit kaskádovou reakci hojení ran a zánětlivou dráhu.Vrozený a adaptivní imunitní systém chrání hostitele před infekcí a bílé krvinky hrají důležitou roli při překrývání mezi těmito dvěma systémy.Konkrétně monocyty, makrofágy, neutrofily a přirozené zabíječské buňky hrají klíčovou roli ve vrozeném systému, zatímco lymfocyty a jejich podskupiny hrají podobnou roli v adaptivním imunitním systému.
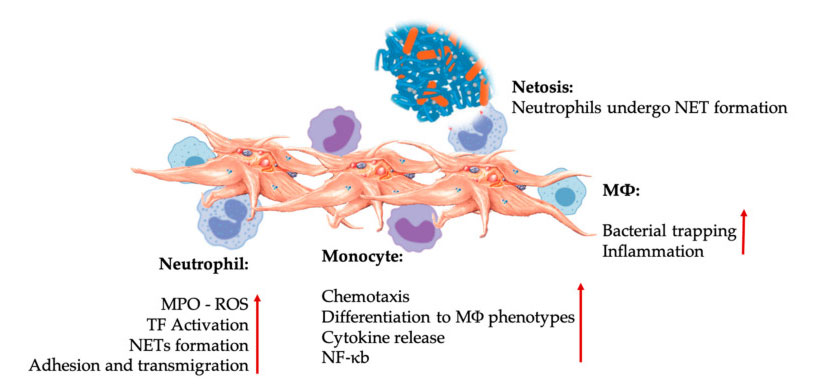
Interakce destiček a leukocytů v interakcích vrozených imunitních buněk.Destičky interagují s neutrofily a monocyty a nakonec s M Φ Interagují, upravují a zvyšují jejich efektorové funkce.Tyto interakce destička-leukocyty vedou k zánětu prostřednictvím různých mechanismů, včetně NETózy.Zkratky: MPO: myeloperoxidáza, ROS: reaktivní formy kyslíku, TF: tkáňový faktor, NET: neutrofilní extracelulární past, NF-κ B: Nukleární faktor kappa B, M Φ: Makrofágy.
Vrozený imunitní systém
Úlohou vrozeného imunitního systému je nespecificky identifikovat invazivní mikroorganismy nebo tkáňové fragmenty a stimulovat jejich odstraňování.Když se určité molekulární struktury nazývané receptory rozpoznávání vzorů povrchové exprese (PRR) spojí s molekulárními vzory souvisejícími s patogeny a molekulárními vzory souvisejícími s poškozením, dojde k aktivaci vrozeného imunitního systému.Existuje mnoho druhů PRR, včetně Toll-like receptor (TLR) a RIG-1 like receptor (RLR).Tyto receptory mohou aktivovat hlavní transkripční faktor kappa B (NF-κB). Reguluje také řadu aspektů vrozené a adaptivní imunitní odpovědi.Je zajímavé, že krevní destičky také exprimují různé imunoregulační receptorové molekuly na svém povrchu a cytoplazmě, jako je P-selektin, ligand transmembránového proteinu CD40 (CD40L), cytokiny (jako je IL-1 β、 TGF- β) a TLR specifický pro destičky. Proto mohou krevní destičky interagovat s různými imunitními buňkami.
Interakce krevních destiček a bílých krvinek ve vrozené imunitě
Když krevní destičky vstoupí nebo napadnou krevní tok nebo tkáň, krevní destičky jsou jednou z buněk, které detekují endoteliální poškození a mikrobiální patogeny jako první.Agregace krevních destiček a podpora uvolňování destičkových agonistů ADP, trombinu a vWF, což vede k aktivaci destiček a expresi destičkových chemokinových receptorů C, CC, CXC a CX3C, což způsobuje destičky v infikovaném místě nebo poranění.
Vrozený imunitní systém je geneticky předurčen k detekci vetřelců, jako jsou viry, bakterie, paraziti a toxiny nebo tkáňové rány a rány.Je to nespecifický systém, protože jakýkoli patogen bude identifikován jako cizí nebo cizí a rychle lokalizován.Vrozený imunitní systém se opírá o sadu proteinů a fagocytů, které rozpoznávají dobře zachované vlastnosti patogenů a rychle aktivují imunitní odpověď, která pomáhá eliminovat vetřelce, i když hostitel nikdy předtím nebyl vystaven konkrétním patogenům.
Neutrofily, monocyty a dendritické buňky jsou nejčastějšími vrozenými imunitními buňkami v krvi.Jejich nábor je nezbytný pro adekvátní včasnou imunitní odpověď.Když se PRP používá v regenerativní medicíně, interakce krevních destiček a bílých krvinek reguluje zánět, hojení ran a opravu tkání.TLR-4 na krevních destičkách stimuluje interakci krevních destiček a neutrofilů, která reguluje tzv. oxidativní vzplanutí leukocytů regulací uvolňování reaktivních forem kyslíku (ROS) a myeloperoxidázy (MPO) z neutrofilů.Kromě toho interakce mezi destičkami-neutrofily a degranulací neutrofilů vede k tvorbě neutrofilně-extracelulárních pastí (NET).NET se skládají z jádra neutrofilů a dalšího intracelulárního obsahu neutrofilů, které mohou zachytit bakterie a zabít je prostřednictvím NETózy.Tvorba NET je základním mechanismem zabíjení neutrofilů.
Po aktivaci krevních destiček mohou monocyty migrovat do nemocných a degenerativních tkání, kde provádějí adhezní aktivity a vylučují zánětlivé molekuly, které mohou změnit chemotaxi a proteolytické vlastnosti.Kromě toho mohou krevní destičky indukovat aktivaci monocytů NF-KB k regulaci efektorové funkce monocytů, což je klíčový mediátor zánětlivé odpovědi a aktivace a diferenciace imunitních buněk.Krevní destičky dále podporují endogenní oxidační vzplanutí monocytů, aby podpořily destrukci fagocytárních patogenů.Uvolňování MPO je zprostředkováno přímou interakcí mezi destička-monocyt CD40L-MAC-1.Je zajímavé, že když P-selektin aktivuje krevní destičky za akutních a chronických zánětlivých tkáňových stavů, mohou z destiček odvozené chemokiny PF4, RANTES, IL-1 β a CXCL-12 zabránit spontánní apoptóze monocytů, ale podporovat jejich diferenciaci na makrofágy.
Adaptivní imunitní systém
Poté, co nespecifický vrozený imunitní systém rozpozná mikrobiální nebo tkáňové poškození, převezme řízení specifický adaptivní imunitní systém.Adaptivní systémy zahrnují antigen vázající B lymfocyty (B buňky) a konvenční T lymfocyty (Treg), které koordinují odstraňování patogenů.T buňky lze zhruba rozdělit na pomocné T buňky (Th buňky) a cytotoxické T buňky (Tc buňky, také známé jako T zabíječe).Th buňky se dále dělí na Th1, Th2 a Th17 buňky, které mají klíčové funkce při zánětu.Th buňky mohou vylučovat prozánětlivé cytokiny (např. IFN-γ、 TNF-β) a několik interleukinů (např. IL-17). Jsou zvláště účinné v prevenci intracelulární virové a bakteriální infekce. Th buňky stimulují proliferaci a diferenciaci buněk zapojených do Tc buňky jsou efektorové buňky, které mohou eliminovat cílené intracelulární a extracelulární mikroorganismy a buňky.
Zajímavé je, že Th2 buňky produkují IL-4 a ovlivňují M Φ polarizaci, M Φ řízenou regeneraci M Φ 2 fenotyp, zatímco IFN- γ M Φ se mění na zánětlivý M Φ 1 fenotyp, který závisí na dávce a době cytokinů.Poté, co je IL-4 aktivován, M Φ2 indukuje Treg buňky k diferenciaci na Th2 buňky a poté produkuje další IL-4 (pozitivní zpětnovazební smyčka).Th buňky konvertují M Φ Fenotyp je zaměřen na regenerační fenotyp v reakci na biologická činidla tkáňového původu.Tento mechanismus je založen na důkazech, že Th buňky hrají významnou roli při kontrole zánětu a opravě tkáně.
Interakce krevních destiček a bílých krvinek v adaptivní imunitě
Adaptivní imunitní systém využívá antigenně specifické receptory a pamatuje si dříve se setkávající patogeny a zničí je, když se následně setká s hostitelem.Tyto adaptivní imunitní reakce se však vyvíjely pomalu.Konias a kol.Ukazuje, že složka krevních destiček přispívá k vnímání rizika a opravě tkáně a že interakce mezi krevními destičkami a leukocyty podporuje aktivaci adaptivní imunitní odpovědi.
Během adaptivní imunitní odpovědi krevní destičky podporují monocytární a makrofágové reakce prostřednictvím zrání DC a NK buněk, což vede ke specifickým odpovědím T buněk a B buněk.Proto složky destičkových granulí přímo ovlivňují adaptivní imunitu expresí CD40L, molekuly, která je nezbytná pro regulaci adaptivní imunitní odpovědi.Krevní destičky prostřednictvím CD40L hrají roli nejen v prezentaci antigenu, ale také ovlivňují reakci T buněk.Liu a kol.Bylo zjištěno, že krevní destičky regulují odpověď CD4 T buněk komplexním způsobem.Tato rozdílná regulace podskupin CD4 T lymfocytů znamená, že krevní destičky podporují CD4 T lymfocyty, aby reagovaly na zánětlivé stimuly, a tak produkovaly silné prozánětlivé a protizánětlivé reakce.
Krevní destičky také regulují adaptivní reakci zprostředkovanou B buňkami na mikrobiální patogeny.Je dobře známo, že CD40L na aktivovaných CD4 T buňkách spustí CD40 B lymfocytů a poskytne druhý signál potřebný pro aktivaci B lymfocytů závislých na T lymfocytech, následnou alotypovou konverzi a diferenciaci a proliferaci B lymfocytů.Obecně výsledky jasně ukazují různé funkce krevních destiček v adaptivní imunitě, což ukazuje, že krevní destičky spojují interakci mezi T buňkami a B buňkami prostřednictvím CD40-CD40L, čímž se zesiluje odpověď B buněk závislá na T-buňkách.Kromě toho jsou krevní destičky bohaté na receptory buněčného povrchu, které mohou podporovat aktivaci krevních destiček a uvolňovat velké množství zánětlivých a biologicky aktivních molekul uložených v různých částicích krevních destiček, čímž ovlivňují vrozenou a adaptivní imunitní odpověď.
Rozšířená role serotoninu pocházejícího z krevních destiček v PRP
Serotonin (5-hydroxytryptamin, 5-HT) má jasnou klíčovou roli v centrálním nervovém systému (CNS), včetně tolerance bolesti.Odhaduje se, že většina lidského 5-HT je produkována v gastrointestinálním traktu a poté prostřednictvím krevního oběhu, kde je absorbován krevními destičkami přes transportér zpětného vychytávání serotoninu a uložen v hustých částicích ve vysoké koncentraci (65 mmol/l).5-HT je dobře známý neurotransmiter a hormon, který pomáhá regulovat různé neuropsychologické procesy v CNS (centrální 5-HT).Většina 5-HT však existuje mimo CNS (periferní 5-HT) a podílí se na regulaci systémových a buněčných biologických funkcí mnoha orgánových systémů, včetně kardiovaskulárních, plicních, gastrointestinálních, urogenitálních a funkčních systémů krevních destiček.5-HT má metabolismus závislý na koncentraci na různých typech buněk, včetně adipocytů, epiteliálních buněk a bílých krvinek.Periferní 5-HT je také silný imunitní modulátor, který může stimulovat nebo inhibovat zánět a ovlivnit různé imunitní buňky prostřednictvím svého specifického 5-HT receptoru (5HTR).
Parakrinní a autokrinní mechanismus HT
Aktivita 5-HT je zprostředkována jeho interakcí s 5HTR, což je nadrodina se sedmi členy (5-HT 1 – 7) a nejméně 14 různými podtypy receptorů, včetně nedávno objeveného člena 5-HT 7, jeho periferního a funkce v léčbě bolesti.V procesu degranulace krevních destiček vylučují aktivované krevní destičky velké množství 5-HT odvozeného od krevních destiček, které mohou podporovat vaskulární kontrakci a stimulovat aktivaci sousedních krevních destiček a lymfocytů prostřednictvím exprese 5-HTR na endoteliálních buňkách, buňkách hladkého svalstva a imunitní buňky.Pacala a kol.Byl studován mitotický účinek 5-HT na vaskulární endoteliální buňky a byl stanoven potenciál podpory růstu poškozených krevních cév stimulací angiogeneze.Jak jsou tyto procesy regulovány, není zcela jasné, ale může zahrnovat rozdílné obousměrné signální dráhy v tkáňovém mikroobvodu k regulaci funkcí vaskulárních endoteliálních buněk a buněk hladkého svalstva, fibroblastů a imunitních buněk prostřednictvím specifických 5-HT receptorů na těchto buňkách. .Autokrinní funkce destiček 5-HT po aktivaci destiček byla popsána [REF].Uvolňování 5-HT zvyšuje aktivaci krevních destiček a nábor cirkulujících krevních destiček, což vede k aktivaci signálních kaskádových reakcí a upstream efektorů podporujících reaktivitu krevních destiček.
Imunomodulační 5-HT efekt
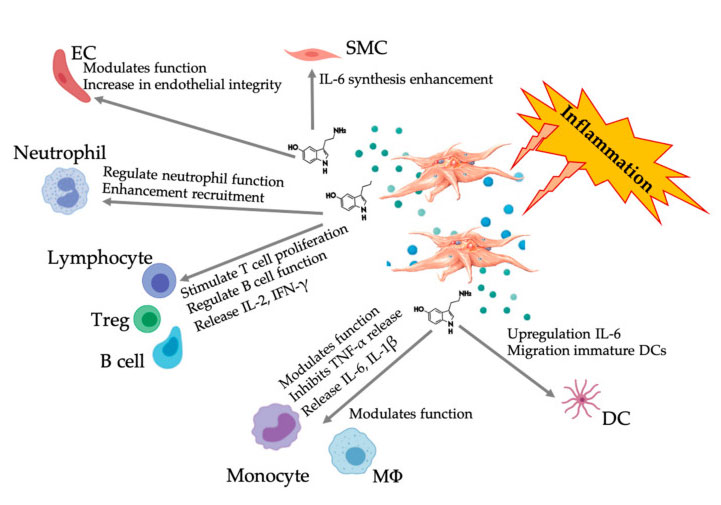
Stále více důkazů ukazuje, že serotonin může hrát roli v různých 5HTR jako imunitní modulátor.Podle 5HTR exprimovaného v různých leukocytech účastnících se zánětlivé reakce působí 5-HT získaný z krevních destiček jako imunitní regulátor jak ve vrozeném, tak v adaptivním imunitním systému.5-HT může stimulovat proliferaci Treg a regulovat funkce B lymfocytů, přirozených zabíječských buněk a neutrofilů rekrutováním DC a monocytů do zánětlivého místa.Nedávné studie ukázaly, že 5-HT získaný z krevních destiček může za specifických podmínek regulovat funkci imunitních buněk.Proto při použití C-PRP může koncentrace krevních destiček vyšší než 1 x 106/µl významně pomoci transportovat koncentraci 5-HT odvozenou z velkých krevních destiček do tkáně.V mikroprostředí charakterizovaném zánětlivými složkami může PRP interagovat s několika imunitními buňkami, které hrají klíčovou roli v těchto patologiích, což může ovlivnit klinické výsledky.
Obrázek znázorňující mnohostrannou odpověď 5-HT po aktivaci zánětlivých krevních destiček PRP.Po aktivaci krevních destiček krevní destičky uvolňují své granule, včetně 5-HT v hustých granulích, který má širokou škálu rozdílných účinků na různé imunitní buňky, endoteliální buňky a buňky hladkého svalstva.Zkratky: SMC: buňky hladkého svalstva, EC: endoteliální buňky, Treg: konvenční T lymfocyty, M Φ: Makrofágy, DC: dendritické buňky, IL: interleukin, IFN-γ: Interferon γ。 Upraveno a upraveno podle Everts et al.a Hull a kol.
Analgetický účinek PRP
Aktivované krevní destičky uvolní mnoho prozánětlivých a protizánětlivých mediátorů, které mohou nejen způsobit bolest, ale také snížit zánět a bolest.Po aplikaci typická dynamika krevních destiček PRP změní mikroprostředí před opravou a regenerací tkáně prostřednictvím různých komplexních drah souvisejících s anabolismem a katabolismem, buněčnou proliferací, diferenciací a regulací kmenových buněk.Tyto charakteristiky PRP vedou k aplikaci PRP u různých klinických patologických stavů obvykle spojených s chronickou bolestí (jako je sportovní zranění, ortopedická onemocnění, onemocnění páteře a komplexní chronická rána), i když přesný mechanismus nebyl plně stanoven.
V roce 2008 Evertz a spol.Jde o první randomizovanou kontrolovanou studii uvádějící analgetický účinek přípravku PRP, který je připraven z hnědé vrstvy rychlosti sedimentace autologních erytrocytů a aktivován autologním trombinem po operaci ramene.Zaznamenali významné snížení skóre na vizuální analogové škále, použití analgetik na bázi opioidů a úspěšnější pooperační rehabilitaci.Je pozoruhodné, že odrážejí analgetický účinek aktivovaných krevních destiček a spekulují o mechanismu, kdy krevní destičky uvolňují 5-HT.Stručně řečeno, krevní destičky v čerstvě připravené PRP spí.Po aktivaci krevních destiček přímo nebo nepřímo (tkáňový faktor) krevní destičky mění tvar a produkují dostatečně falešné, aby podpořily agregaci krevních destiček.Poté uvolňují intracelulární α-A husté částice.Tkáň ošetřená aktivovaným PRP bude invazována PGF, cytokiny a dalšími lysozomy krevních destiček.Přesněji řečeno, když husté částice uvolní svůj obsah, uvolní velké množství 5-HT, který reguluje bolest.U C-PRP je koncentrace krevních destiček 5 až 7krát vyšší než v periferní krvi.Proto je uvolňování 5-HT z krevních destiček astronomické.Zajímavé je, že Sprott a kol.Zpráva zjistila, že bolest byla významně zmírněna po akupunktuře a moxování, koncentrace 5-HT odvozeného z krevních destiček byla významně snížena a poté byla zvýšena hladina 5-HT v plazmě.
V periferní části budou krevní destičky, žírné buňky a endoteliální buňky uvolňovat endogenní 5-HT během poranění tkáně nebo chirurgického traumatu.Je zajímavé, že v periferní oblasti byly detekovány různé 5-HT receptory neuronů, což potvrdilo, že 5-HT může interferovat s nociceptivním přenosem v periferní oblasti.Tyto studie ukazují, že 5-HT může ovlivnit nociceptivní přenos periferních tkání prostřednictvím receptorů 5-HT1, 5-HT2, 5-HT3, 5-HT4 a 5-HT7.
Systém 5-HT představuje výkonný systém, který dokáže snížit a zvýšit míru bolesti po škodlivé stimulaci.U pacientů s chronickou bolestí byla hlášena centrální a periferní regulace nociceptivních signálů a změny v 5-HT systému.V posledních letech se velký počet studií zaměřil na roli 5-HT a jeho příslušných receptorů při zpracování a regulaci škodlivých informací, což vedlo k lékům, jako jsou selektivní inhibitory zpětného vychytávání serotoninu (SSRI).Tento lék inhibuje zpětné vychytávání serotoninu do presynaptických neuronů po uvolnění serotoninu.Ovlivňuje délku a intenzitu serotoninové komunikace a je alternativní léčbou chronické bolesti.K jasnému pochopení molekulárního mechanismu regulace bolesti 5-HT odvozené od PRP u chronických a degenerativních onemocnění je zapotřebí dalšího klinického výzkumu.
Další údaje k vyřešení potenciálního analgetického účinku PRP lze získat po testu analgetického zvířecího modelu.Srovnávací statistické závěry v těchto modelech jsou náročné, protože tyto studie obsahují příliš mnoho proměnných.Nicméně některé klinické studie se zabývaly nociceptivními a analgetickými účinky PRP.Několik studií ukázalo, že pacienti léčení tendinózou nebo natržením rotátorové manžety mají malou úlevu od bolesti.Naproti tomu několik dalších studií ukázalo, že PRP může snížit nebo dokonce odstranit bolest pacientů s degenerací šlach, OA, plantární fasciitidou a dalšími onemocněními nohou a kotníků.Konečná koncentrace krevních destiček a biologické složení buněk byly identifikovány jako klíčové vlastnosti PRP, které pomáhají pozorovat konzistentní analgetický účinek po aplikaci PRP.Mezi další proměnné patří způsob podávání PRP, aplikační technologie, protokol aktivace krevních destiček, úroveň biologické aktivity PGF a uvolněných cytokinů, typ tkáně aplikace PRP a typ poranění.
Je pozoruhodné, že Kuffler vyřešil potenciál PRP při zmírňování bolesti u pacientů s mírnou až těžkou chronickou neuropatickou bolestí, sekundární k poškozenému neregeneračnímu nervu.Účelem této studie je zjistit, zda lze neuropatickou bolest snížit nebo ustoupit díky PRP podporujícímu regeneraci axonů a reinervaci cílového nervu.Překvapivě mezi pacienty, kteří dostávají léčbu, je neuropatická bolest stále odstraněna nebo zmírněna alespoň šest let po operaci.Všem pacientům navíc začalo do tří týdnů po aplikaci PRP ulevovat od bolesti.
Nedávno byly podobné analgetické účinky PRP pozorovány v oblasti pooperační péče o rány a kůži.Je zajímavé, že autoři uvádějí fyziologické aspekty bolesti v ráně spojené s poraněním cév a hypoxií kožní tkáně.Diskutovali také o důležitosti angiogeneze při optimalizaci okysličování a dodávání živin.Jejich studie ukázala, že ve srovnání s kontrolní skupinou měli pacienti léčení PRP méně bolesti a významně zvýšenou angiogenezi.Nakonec Johal a jeho kolegové provedli systematický přehled a metaanalýzu a dospěli k závěru, že PRP může snížit bolest po použití PRP v ortopedických indikacích, zejména u pacientů, kteří dostávají externí epikondylitidu a léčbu OA kolena.Bohužel tato studie nespecifikovala účinky bílých krvinek, koncentraci krevních destiček ani použití exogenních aktivátorů krevních destiček, protože tyto proměnné by ovlivnily celkovou účinnost PRP.Optimální koncentrace krevních destiček PRP pro maximální úlevu od bolesti není jasná.Na potkaním modelu tendinózy byla koncentrace krevních destiček 1,0 × 10 6 / μ Při L lze bolest zcela zmírnit, zatímco úleva od bolesti způsobená PRP s poloviční koncentrací krevních destiček je významně snížena.Proto doporučujeme další klinické studie, které by zkoumaly analgetické účinky různých přípravků PRP.
PRP a účinek angiogeneze
Preparáty C-PRP v přesné regenerativní medicíně umožňují dodání biomolekul uvolněných vysokými koncentracemi krevních destiček aktivovaných v místech cílové tkáně.Proto byly zahájeny různé kaskádové reakce, které přispívají k imunitní regulaci na místě, zánětlivému procesu a angiogenezi k podpoře hojení a opravy tkáně.
Angiogeneze je dynamický vícestupňový proces zahrnující klíčení a tkáňové mikrocévy z již existujících krevních cév.Angiogeneze pokročila díky řadě biologických mechanismů, včetně migrace endoteliálních buněk, proliferace, diferenciace a dělení.Tyto buněčné procesy jsou předpokladem pro tvorbu nových krevních cév.Jsou nezbytné pro růst již existujících krevních cév, aby se obnovil průtok krve a podpořila vysoká metabolická aktivita opravy tkání a regenerace tkání.Tyto nové krevní cévy umožňují dodávání kyslíku a živin a odstraňování vedlejších produktů z ošetřených tkání.
Aktivita angiogeneze je regulována stimulací angiogenního faktoru VEGF a antiangiogenních faktorů (např. angiostatin a trombospondin-1 [TSP-1]).V nemocném a degradovaném mikroprostředí (včetně nízkého napětí kyslíku, nízkého pH a vysoké hladiny kyseliny mléčné) obnoví aktivitu angiogeneze lokální angiogenní faktory.
Několik médií rozpustných v destičkách, jako je bazický FGF a TGF-β a VEGF, může stimulovat endoteliální buňky k produkci nových krevních cév.Landsdown a Fortier uvedli různé výsledky týkající se složení PRP, včetně intraagregačních zdrojů mnoha angiogenních regulátorů.Kromě toho došli k závěru, že zvýšení angiogeneze přispívá k hojení onemocnění MSK v oblastech se špatnou vaskularizací, jako je trhlina menisku, poranění šlach a další oblasti se špatnou vaskularizací.
Podpora a antiangiogenní vlastnosti krevních destiček
V posledních několika desetiletích publikované studie prokázaly, že krevní destičky hrají klíčovou roli v primární hemostáze, tvorbě sraženin, uvolňování růstového faktoru a cytokinů a regulaci angiogeneze jako součást procesu opravy tkáně.Paradoxně PRP α- Granule obsahují arzenál proangiogenních růstových faktorů, antiangiogenních proteinů a cytokinů (jako je PF4, inhibitor aktivátoru plazminogenu-1 a TSP-1) a zaměřují se na uvolňování specifických faktorů, které hrají roli .Role v angiogenezi.Role PRP při kontrole regulace angiogeneze tedy může být definována aktivací specifických receptorů buněčného povrchu, TGF-p iniciuje proangiogenní a antiangiogenní reakce.Schopnost krevních destiček vykonávat dráhu angiogeneze byla potvrzena u patologické angiogeneze a nádorové angiogeneze.
Destičkový angiogenní růstový faktor a antiangiogenní růstový faktor, odvozený z α-A hustých a adhezivních molekul.Nejdůležitější je, že se obecně uznává, že celkový účinek krevních destiček na angiogenezi je proangiogenní a stimulující.Očekává se, že terapie PRP bude kontrolovat indukci angiogeneze, která přispěje k léčebnému účinku mnoha onemocnění, jako je hojení ran a reparace tkání.Podávání PRP, konkrétněji podávání vysoké koncentrace PGF a dalších cytokinů krevních destiček, může vyvolat angiogenezi, angiogenezi a arteriogenezi, protože faktor 1a odvozený ze stromálních buněk se váže na CXCR4 receptor na endoteliálních progenitorových buňkách.Bill a kol.Předpokládá se, že PRP zvyšuje ischemickou neovaskularizaci, která může být způsobena stimulací angiogeneze, angiogeneze a arteriogeneze.V jejich in vitro modelu byla proliferace endoteliálních buněk a tvorba kapilár indukována velkým počtem různých PDG, z nichž VEGF byl hlavním angiogenním stimulátorem.Dalším důležitým a podstatným faktorem pro obnovu dráhy angiogeneze je synergie mezi více PGF.Richardson a kol.Bylo prokázáno, že synergická aktivita angiogenního faktoru destičkového růstového faktoru-bb (PDGF-BB) a VEGF vedla k rychlé tvorbě zralé vaskulární sítě ve srovnání s aktivitou individuálního růstového faktoru.Kombinovaný účinek těchto faktorů byl nedávno potvrzen ve studii o zlepšení cerebrální kolaterální cirkulace u myší s dlouhodobou hypoperfuzí.
Nejdůležitější je, že studie in vitro měřila proliferativní účinek endoteliálních buněk lidské pupečníkové žíly a různé koncentrace krevních destiček na výběr zařízení pro přípravu PRP a strategii dávkování krevních destiček a výsledky ukázaly, že optimální dávka krevních destiček byla 1,5 × 10 6 krevních destiček/μ 50. Podporovat angiogenezi.Příliš vysoká koncentrace krevních destiček může inhibovat proces angiogeneze, takže účinek je slabý.
Stárnutí buněk, stárnutí a PRP
Senescence buněk může být vyvolána různými podněty.Jde o proces, při kterém se buňky přestanou dělit a podstoupí jedinečné fenotypové změny, aby se zabránilo neomezenému růstu poškozených buněk, což hraje důležitou roli v prevenci rakoviny.V procesu fyziologického stárnutí bude stárnutí replikace buněk také podporovat stárnutí buněk a schopnost regenerace MSC bude snížena.
Účinky stárnutí a stárnutí buněk
In vivo mnoho typů buněk stárne a hromadí se v různých tkáních během stárnutí, mezi nimiž je velké množství stárnoucích buněk.Zdá se, že akumulace stárnoucích buněk se zvyšuje s přibývajícím věkem, poškozením imunitního systému, poškozením tkání nebo faktory souvisejícími se stresem.Mechanismus buněčného stárnutí byl identifikován jako patogenní faktor onemocnění souvisejících s věkem, jako je osteoartritida, osteoporóza a degenerace meziobratlové ploténky.Různé podněty zhorší stárnutí buněk.V reakci na sekreční fenotyp související se stárnutím (SASP) bude vylučovat vysoké koncentrace proteinových buněk a cytokinů.Tento speciální fenotyp souvisí se stárnutím buněk, ve kterých vylučují vysoké hladiny zánětlivých cytokinů (jako je IL-1, IL-6, IL-8), růstových faktorů (jako je TGF-β、 HGF, VEGF, PDGF), MMP a katepsin.Bylo prokázáno, že ve srovnání s mladými lidmi se SAPS s věkem zvyšuje, protože proces ustáleného stavu je zničen, což má za následek stárnutí buněk a sníženou schopnost regenerace.Konkrétně u onemocnění kloubů a onemocnění kosterního svalstva.V tomto ohledu je imunitní stárnutí považováno za významnou změnu v sekrečním spektru imunitních buněk, což naznačuje, že se zvyšuje koncentrace TNF-a, IL-6 a/nebo IL-1b, což vede k chronickému zánětu nízkého stupně.Stojí za zmínku, že dysfunkce kmenových buněk souvisí také s nebuněčnými autonomními mechanismy, jako jsou stárnutí buněk, zejména produkce prozánětlivých a antiregeneračních faktorů prostřednictvím SASP.
Naopak SASP může také stimulovat buněčnou plasticitu a přeprogramování sousedních buněk.Kromě toho může SASP organizovat komunikaci s různými imunitními mediátory a aktivovat imunitní buňky, aby podpořily odstranění stárnoucích buněk.Pochopení role a funkce stárnoucích buněk přispěje k hojení a tkáňové remodelaci svalů MSK a chronických ran.
Je pozoruhodné, že Ritcka a kol.Byla provedena rozsáhlá studie a byla objevena hlavní a prospěšná role SASP při podpoře buněčné plasticity a regenerace tkání a byl představen koncept přechodného ošetření stárnoucích buněk.Opatrně zmínili, že stárnutí je hlavně blahodárný a regenerační proces.
Stárnutí buněk a potenciál PRP
Jak se počet kmenových buněk snižuje, stárnutí ovlivní výkon kmenových buněk.Podobně u lidí se vlastnosti kmenových buněk (jako je suchost, proliferace a diferenciace) s věkem také snižují.Wang a Nirmala uvedli, že stárnutí by snížilo charakteristiky kmenových buněk šlachových buněk a počet receptorů růstových faktorů.Studie na zvířatech ukázala, že koncentrace PDGF u mladých koní byla vysoká.Došli k závěru, že zvýšení počtu GF receptorů a počtu GF u mladých jedinců může mít lepší buněčnou odpověď na léčbu PRP než starší jedinci u mladých jedinců.Tato zjištění odhalují, proč může být léčba PRP méně účinná nebo dokonce neúčinná u starších pacientů s menším počtem kmenových buněk a „špatnou kvalitou“.Bylo prokázáno, že proces stárnutí chrupavky je obrácený a doba klidu chondrocytů se prodlužuje po injekci PRP.Jia a kol.Používá se ke studiu myších dermálních fibroblastů in vitro fotostárnutí, s ošetřením PRP a bez něj, aby se objasnil mechanismus působení PGF v tomto modelu.Skupina PRP vykazovala přímý účinek na extracelulární matrix, zvýšený kolagen typu I a sníženou syntézu metaloproteináz, což naznačuje, že PRP může působit proti stárnutí buněk a také u degenerativního onemocnění MSK.
V jiné studii byl PRP použit k odběru starých kmenových buněk kostní dřeně ze starých myší.Bylo zjištěno, že PRP může obnovit různé funkce kmenových buněk ze stárnutí, jako je buněčná proliferace a tvorba kolonií, a rekonstruovat markery související se stárnutím buněk.
Oberlohr a jeho kolegové nedávno rozsáhle studovali roli buněčného stárnutí při oslabení svalové regenerace a hodnotili PRP a plazmu chudou na destičky (PPP) jako biologické možnosti léčby pro opravu kosterního svalstva.Předpokládali, že léčba PRP nebo PPP pro opravu kosterního svalstva bude založena na biologických faktorech přizpůsobených pro SASP specifické buněčné markery a další faktory, které vedou k rozvoji fibrózy.
Je rozumné se domnívat, že před aplikací PRP může cílené stárnutí buněk zlepšit regenerační charakteristiky účinnosti biologické léčby snížením lokálních faktorů SASP.Bylo navrženo, že další možností, jak zlepšit výsledky léčby PRP a PPP pro regeneraci kosterního svalstva, je selektivně odstranit stárnoucí buňky pomocí scavengerů.Není pochyb o tom, že nedávné výsledky výzkumu o vlivu PRP na stárnutí buněk a stárnutí jsou fascinující, ale jsou stále v počáteční fázi.Proto je v tuto chvíli nerozumné předkládat jakékoli návrhy.
(Obsah tohoto článku je přetištěn a neposkytujeme žádnou výslovnou ani předpokládanou záruku za přesnost, spolehlivost nebo úplnost obsahu obsaženého v tomto článku a neneseme odpovědnost za názory na tento článek, pochopte prosím.)
Čas odeslání: březen-01-2023